پنجشنبه 14 مرداد 1400 کد خبر: 110

۱- مقدمه
اندازه ذراتی که با واکنشهای مختلف ترسیب شیمیایی بهدست میآید، میتواند تاحد زیادی متغییر باشد. این گستره محدودهای از نانوکلوئیدها تا رسوبهای درشت کریستالی را در بر میگیرد. کلوئیدهای ریز که معمولا با چشم نیز تشخیص داده نمیشوند، تمایلی به نشست از خود نشان نمیدهند (به دلیل حرکت براونی) و در طول روزها و ماهها پایدار باقی میمانند، اما رسوبهای درشت دانه به سرعت و بهطور خود به خودی رسوب میکنند. برخلاف رسوبهای کلوئیدی، رسوبهای درشتتر را میتوان به راحتی با فرآیندهایی همچون فیلتراسیون، سانتریفیوژ کردن و سرریز کردن[۱] جداسازی نمود. همانگونه که در مقاله پیشین از این بحث مطرح شد، فرآیندهای سنتز نانوذرات با ترسیب شیمیایی، سازوکار (مکانیسم) پیچیدهای دارند که در بسیاری موارد نیز ناشناخته مانده است. این مقاله بهصورت اختصاصی و با زبانی ساده به بیان مکانیسم چنین فرآیندهایی میپردازد. انتخاب صحیح متغیرهای واکنش میتواند منجر به کنترل مراحل مختلف شده و محصولی نانوساختار با شکل و اندازه مورد انتظار را فراهم میآورد.
۲- مکانیسم فرایندهای ترسیبی
هرچند مکانیسم پیچیده ترسیب از محلول هنوز بهطور کلامل شناخته نشده است، اما به عنوان رویکردی پایین به بالا، مراحل هستهزایی[۲] و رشد[۳] دو بخش اصلی این فرآیند هستند.
۱-۲- هستهزایی
هستهها اولین ذرات از فاز مشخصی از ماده هستند که طی فرآیند (در اینجا فرآیندهای سنتزی) ایجاد میشوند. در هستهزایی، تعداد کمی از یونها، اتمها یا مولکولها (انگشتشمار) بهدور یکدیگر جمعشده و هستهی اولیه را تشکیل میدهند. این فرآیند میتواند از محیط گازی یا محیط محلول صورت بگیرد. در صورتی که هستهها بر جایگاههای خاصی از سطوح موجود در محیط واکنش ایجاد شوند، فرآیند تحت عنوان هستهزایی ناهمگن[۴] شناخته میشود. در بسیاری موارد هسته اولیه بر سطح یک ناخالصی (مثل یک ذره غبار و ...) یا سطوح ناصاف ظرف واکنش تشکیل میشوند. در رویکرد دیگر، هستهزایی به جایگاه خاصی نیاز ندارد و تعداد زیادی از هستههای اولیه بهطور همزمان بر اثر تغییرات فیزیکی شدید (مثلا تغییرات دمایی) به صورت تودهای متولد میشوند. بهاین فرآیند هستهزایی همگن گفته میشود. هستهزایی ناهمگن فرآیند محتملتری است چرا که بهانرژی پایینتری در مقایسه با رویکرد همگن نیازمند است.
معمولا رسوبگیری از محلول تحت شرایط فوق اشباعیت[۵] بالا صورت میپذیرد. به عبارت دیگر میتوان گفت که فاز مایع بر اثر پیشرفت یک واکنش خاص از محصول کم محلول (Sparingly Soluble) اشباع میشود. از این نقطه به بعد، محصول ایجاد شده از فاز محلول مستقیما به فاز جامد وارد میشود (رسوب میکند). در اصل میتوان گفت که این فوقاشباعیت است که فرآیند هستهزایی را کلید میزند. فوق اشباعیت (S) نسبت غلظت حل شوندهها در حالت اشباع نسبت به این غلظت در حالت تعادل است. هرچه نسبت فوق بزرگتر باشد، محلول سریعتر به سمت رسوبگذاری پیش میرود. گاه نیز از مفهوم فوقاشباعیت نسبی[۶] برای این منظور استفاده میشود. معادله کمی برای فوق اشباع نسبی در زیر آورده شده است:
![]()
در این معادله، Q غلظت حل شونده را در هر لحظه و S حلالیت تعادلی آن را نشان میدهد. اندازه ذرات بهطور معکوس با این کمیت مرتبط است. بنابراین زمانی که فوق اشباع نسبی بزرگ است، رسوب کلوئیدی است و زمانی که کوچک است، رسوب بلوری بدست میآید. از دیدگاه کمی، سرعت هسته زایی به صورت نمایی با فوق اشباعیت نسبی تغییر میکند.
۲-۲- رشد
فرآیند رشد از هستهزایی هم پیچیدهتر است. فرآیند رشد با افزوده شدن واحدهای ساختاری بلور به یکدیگر (گاه اجزای ساختاری پلیمر و ...) و قرارگیری آنها در جایگاه مناسب با جهتگیری درست اتفاق میافتد. از آنجا که در بسیاری موارد رشد بلور بهسرعت پیش میرود، جهتگیریها به درستی صورت نگرفته و بلور دارای نقصهایی همچون نقص جابجایی[۷] میشود.
 شکل ۱- شمای نقص بلوری و تصویر میکروسکوپ الکترونی (با قدرت تفکیک بالا)
شکل ۱- شمای نقص بلوری و تصویر میکروسکوپ الکترونی (با قدرت تفکیک بالا)
گاه رشد تنها در یک جهت بلور صورت میگیرد و لذا محصول نهایی در جهات مختلف خصوصیات منحصر بهفرد از خود نشان میدهد. رشد میتواند با فرآیندهای انتقال جرم یا با سینتیک واکنش مربوطه محدود شود (فرآیندهای انتقال جرم در کل سهم مهمتری دارند). در بسیاری موارد، فرآیند رشد با پدیده نفوذ محدود میشود. در این حالت، فوقاشباعیت در لبههای بلور بیش از وجوه آن است. همین مسئله به جوانهزنی بلور از گوشهها منتهی میشود و از ایجاد ساختار چند وجهی[۸] منظم جلوگیری میکند. در حالت پیشرفته، این روند منجر به تشکیل بلورهای درختسانی میشود. در شکل ۲ بلورهای چندوجهی (الف) و درختسانی (ب) نشان دادهشدهاست.
 شکل ۲- ساختار بلورهای چند وجهی (الف) و درختسانی (ب) با درنظر گرفتن مراحل تشکیل
شکل ۲- ساختار بلورهای چند وجهی (الف) و درختسانی (ب) با درنظر گرفتن مراحل تشکیل
۳-۲- عملاوری استوالد[۹]
حتی با کنترل کامل بر مراحل هسته زایی و رشد، بازهم اندازه ذرات میتواند دستخوش تغییراتی قرار گیرد. زمانی که محلول کلوئیدی مدت زمانی باقی میماند، به مرور ذرات کوچکتر حذف شده و ذرات باقی مانده بزرگ میشوند. این فرآیند تحت عنوان عملآوری استوالد شناخته میشود. در اصل این ذرات کوچکترهستند که قربانی میشوند تا در مقدار محدودی از ماده ذرات بزرگتر قابلیت رشد را داشته باشند. اساس فرآیند هضم رسوب[۱۰] نیز فرآیند عملآوری استوالد است. در مواردی که بلور درشت اندازه نیاز است (برخلاف رویکرد سنتزی در نانومواد)، رسوبهای کلوئیدی را برای چند ساعت در حضور حلال و حرارت قرار میدهند. در شکل زیر شمایی از عملآوری استوالد آورده شدهاست:
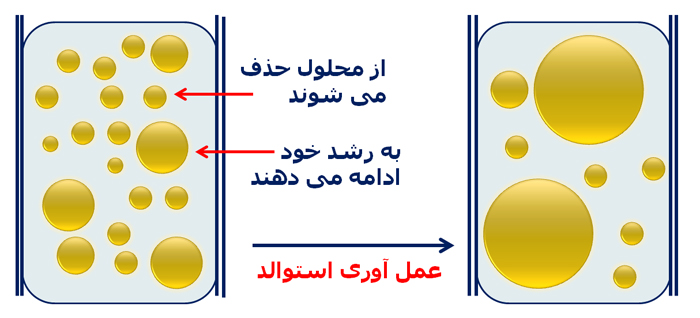 شکل ۳- فرآیند عملآوری استوالد. مصرف ذرات ریز در محصول به تولید ذرات درشتتر میانجامد.
شکل ۳- فرآیند عملآوری استوالد. مصرف ذرات ریز در محصول به تولید ذرات درشتتر میانجامد.
عملآوری استوالد اساسا برپایه تمایل ذاتی ذرات محلول به تشکیل ساختار پایدار (و با انرژی کمتر) حاصل میشود. اصولا هرچه ذرات ریزتر باشند، نسبت اتمها (یا مولکولهای سطحی) نسبت به توده بالاتر است و این بهمعنی انرژی بیشتر برای کل ذرات تشکیلدهنده محلول میباشد. نتیجتا فرآیند عملآوری استوالد که در آن ذرات در کل بهسمت افزایش اندازه پیش میروند، باعث حذف برخی ذرات با اندازههای کوچکتر و افزایش اندازه ذرات باقیمانده میشود. این پدیده نهتنها باعث انحراف در اندازه مورد انتظار برای ذرات محصول میشود، بلکه میتواند گستره پخش اندازه ذرات را تغییر دهد. در موارد پیشرفته، حتی دو گستره مجزا از ذرات با اندازه ریز و اندازه درشت از محصولات فراهم میآید.
۳- کنترل عملی اندازه ذرات
۱-۳- کنترل متغیرهای سنتز
در طول مرحله هستهزایی، تقریبا تمامی ذرات محصول متولد میشوند. در این مرحله است که تعداد بسیار زیادی از ذرات با اندازه بسیار کوچک تولید میشود. این در حالی است که کنترل بر مرحله رشد میتواند ذرات با اندازه همگن را ایجاد نماید. کنترل فرآیند هستهزایی نقشی اساسی در محصول نهایی دارد. همچنین فرآیندهای ثانویهای همچون کلوخهای شدن و عملآوری استوالد نیز در اندازه محصول نهایی دخیل است. به دلیل آنکه فرآیندهای پیچیده هستهزایی، رشد و کلوخهای شدن همه تقریبا همزمان صورت میگیرند، کنترل زیادی جهت تهیه ذرات تکپخش مورد نیاز است.
جهت کنترل کیفیت محصول سنتزی، در بسیاری از موارد سعی میشود تا فرآیند هستهزایی بهطور کامل پیشاز فرآیند رشد بهاتمام برسد. در این حالت میتوان امیدوار بود که ذراتی با اندازه یکسان بهدست بیاید. در صورتی که این فرآیندها بایکدیگر تداخل داشته باشند، اندازه ذرات گستره وسیعی خواهد داشت. برای مثال بسته به نوع سنتز طراحی شده، در ابتدا شرایط شدیدی اعمال میشود تا بر اثر فوق اشباعیت بالا، هسته زایی در زمان کمی به اتمام برسد. در مرحله بعد، شرایط ملایمتری اعمال میشود. در این شرایط هستهزایی تا حد زیادی اتفاق نیفتاده اما فرآیند رشد پدیده قالب است. هستههای ایجاد شده در مرحله اولیه میتوانند به صورت همگن رشد کنند و در نتیجه ذراتی با اندازههای کمابیش مشابه تهیه میشود.
همانگونه که در تبیین مکانیسم واکنشهای رسوبی بیان شده، فوقاشباعیت نقشی عمده را در آغاز و پیشرفت این فرآیند و همچنین کیفیت محصول نهایی بازی میکند. در سنتز نانومواد، فراهم آوردن ذرات بسیار ریز نانوکلوئیدی از واکنش رسوبی مطلوب است. اصولا هر عاملی که فوق اشباعیت را در محلول افزایش دهد، به ریز شدن محصول نهایی (بدون در نظر گرفتن فرآیندهای ثانویه مثل عملآوری و کلوخهای شدن) یاری رسانده است. بهطور تجربی ثابت شده که عواملی همچون حلالیت رسوب[۱۱]، دما، غلظت واکنشگرها، شدت بهمخوردن محلول و اختلاط واکنشگرها و همچنین حضور عوامل کمپلکسدهنده[۱۲] و پایدار کننده[۱۳] میتواند در تعیین اندازه نهایی ذرات موثر باشد.
زمانی که محصول ذاتا یک ترکیب نامحلول در آب است (با Ksp بسیار پایین)، فوق اشباعیت نیز عملا بالاست. در مقابل برای ترکیباتی که تاحدی در محیط آبی انحلال پذیرند، کنترل ویژه شرایط جهت نیل به محصولی با کیفیت مطلوب، ضروری بهنظر میرسد. برای مثال گاه با کنترل pH و دما میتوان حلالیت محصول را تغییر داد و لذا بهینهکردن این مقادیر در فرآیند سنتز ضروری بهنظر میرسد. در مقادیری از pH یا دما که حلالیت کمتر است، فوق اشباعیت بالاتر بوده و ذرات ریزتری به دست میآیند. در مقابل گاه اعمال دماهای بالاتر واکنش تشکیل رسوب را تسریع نموده و با بالابردن فوق اشباعیت بلورهای ریزتر را فراهم میآورد. هنگامی که فرآیند هستهزایی بر رشد ارجحیت دارد، تعداد زیادی از هستههای ریز و در شرایطی که رشد پدیده قالب است، تعداد کمی از ذرات درشت تهیه میشود. سرعت هستهزایی به طور شدید با فوق اشباع نسبی متغیر است، این در حالی است که فرآیند رشد تنها کمی با افزایش فوق اشباع نسبی افزایش مییابد.
۲-۳- پایدارسازی سطح نانوذرات
نانوذرات به دلیل انرژی سطحی بسیار بالا تمایل بسیاری جهت بههم چسبیدن و کلوخهای شدن دارند. در مقابل در نانوفناوری، ما به محلولهای کلوئیدی پایدار و همچنین نانوپودرهای جداسازی شده از محلول نیازمندیم. در حالت کلی دو رویکرد برای پایدارسازی سطح نانوذرات و درنتیجه پیشگیری از پدیده کلوخهای شدن ارائه شده است. رویکرد اول ایجاد دافعه بین نانوذرات است. بر این اساس ذرات در محلول از یکدیگر مجزا مانده و کلوخهای شدن اتفاق نمیافتد. جهت نیل به این هدف از ترکیبات شیمیایی مانند سورفکتانتها، پلیمرها یا برخی ترکیبات آلی دیگر در محیط تشکیل نانوذرات استفاده میشود. این ترکیبات معمولا تحت عنوان عوامل پوشاننده[۱۴] نیز شناخته میشوند. رویکرد دوم ایجاد دافعه الکترواستاتیک (واندروالس) در میان نانوذرات است. در بسیاری موارد این پدیده بر اثر جذب شیمیایی یونهایی نظیر هیدروکسیل () و پروتون () یا دیگر عوامل باردار بر سطح نانوذرات اتفاق میافتد. لذا نانوذرات تشکیل شده همبار بوده و یکدیگر را دفع میکنند. معمولا جذب یونهای هیدروکسیل یا پروتون در pH های بسیار بالا یا پایین در محلولهای آبی اتفاق میافتد. شمایی از هر دو رویکرد در شکل ۴ آورده شده است. گاه نیز عامل پایدارکننده میتواند هر دو نقش را بهصورت همزمان ایفا نماید.
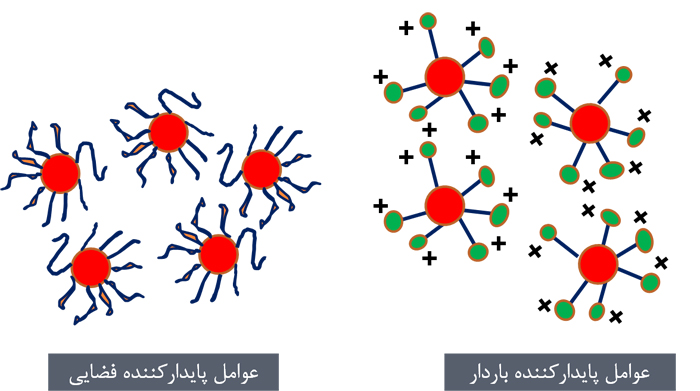 شکل ۴- عوامل پایدارکننده سطح نانوذرات
شکل ۴- عوامل پایدارکننده سطح نانوذرات
حتی در عدم حضور هر عامل پایدارکننده، لایهای از یونها اطراف ذرات کلوئیدی را فرا میگیرد. از آنجا که این لایه از دوبخش لایه یونهای اولیه[۱۵] و لایه یونهای متقابل[۱۶] تشکیل شدهاست، لایه دوگانه نامیده میشود. لایه یونهای اولیه و لایه یونهای متقابل دارای بار ناهمناماند و لایه دوگانه در کل خنثی است. لایه دوگانه به دلیل دافعه الکترواستاتیکی از نزدیک شدن ذرات به یکدیگر جلوگیری میکند و لذا مانع از کلوخهای شدن میشود. در نتیجه میتوان گفت که ضخیم شدن این لایه نقشی عمده را در ممانعت از الحاق نانوذرات به یک دیگر و کلوخهای شدن بازی میکند. در حالت عکس، کاهش ضخامت لایه دوگانه احتمال کلوخهای شدن را افزایش میدهد. شکل ۵ این مورد را نشان میدهد.
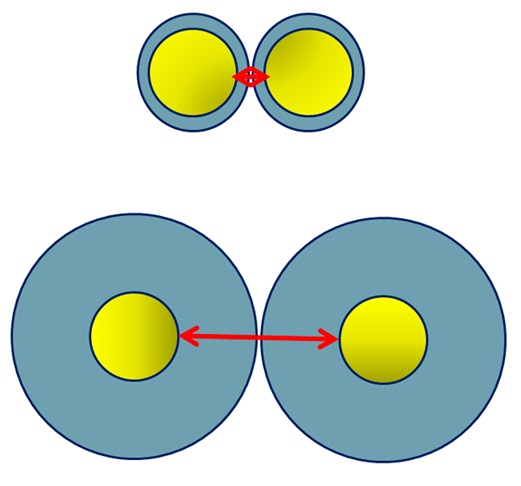 شکل ۵- ساختار دولایه پیرامون ذرات کلوئیدی
شکل ۵- ساختار دولایه پیرامون ذرات کلوئیدی
لایه دوگانه در محلولی با قدرت یونی پایین ضخیم است. قدرت یونی یک کمیت در شیمی تجزیه است که به مقدار یونهای آزاد در محلول بستگی دارد. در یک محلول با قدرت یونی بالا، غلظت یونهای آزاد زیاد است و لذا این باعث میشود تا لایه دوگانه فشرده شده و ضخامت کمتری داشته باشد. به صورت عکس، در قدرت یونی پایین، لایه دوگانه چگالی کمتری داشته و ضخیم میشود (امکان برخورد و کلوخهای شدن ذرات کلوئیدی کاهش مییابد). معمولا لایه دوگانه ضخیم در pH های خنثی دست یافتنی است. در این مورد یونهای +H یا -OH کمی در محلول حضور دارند و لذا قدرت یونی محلول پایین است. همچنین هنگامی که در فرآیند سنتز نسبت افزودن پیشمادهها بهخوبی با یکدیگر تنظیم شده است، یون واکنشگر اضافی در محلول وجود ندارد و قدرت یونی پایین است. هرچند در این حالت نیز، هنوز یونهای متقابل زیادی در محلول وجود دارند که (در صورت امکان) با شستشوی رسوب میتوانند تا حد زیادی حذف شوند.
۳-۳- فرایندهای حرارتی ثانویه
بسیاری از ترکیباتی که با روشهای همرسوبی خصوصا در دماهای پایین ایجاد میشوند، حالت بیشکل دارند. لذا برای بهدست آوردن محصولاتی با ساختار بلوری مناسب، انجام فرآیندهای حرارتی ثانویه همچون کلسینه شدن یا بازپخت ضروری است. همچنین برای دستیابی به ساختارهای اکسیدی، معمولا رسوب بدست آمده در مراحل اولیه تحت تخریب حرارتی قرار میگیرد. چنین فرآیندهای حرارتی ثانویهای میتوانند منجر به کلوخهای شدن و کاهش کنترل بر اندازه ذرات محصول شوند. فرآیندهایی همچون فرآیندهای هیدروترمال[۱۷] و سولوترمال[۱۸] که فاقد مراحل عملآوری ثانویه هستند از این رو بر سایر روشها ارجحیت دارند.
۴- جمعبندی و نتیجهگیری
اندازه و شکل محصولات فرآیندهای همرسوبی با کنترل متغیرهای متعددی قابل پیشبینی است. هرچند بسته به سامانه سنتزی و طبیعت محصول، شرایط بسیار متغیر است، اما اصولی بهعنوان مکانیسم کلی بیان شدهاند. مراحل هستهزایی، رشد از گامهای اصلی سنتزهای رسوبیهستند. فوقاشباعیت عامل اصلی در این فرآیندهاست. همچنین فرآیندهای ثانویهای همچون عملآوری استوالد، بازپخت و کلسینه کردن میتوانند منجر به کلوخهای شدن (تجمع) و رشد ناخواسته اندازه ذرات شوند. کنترل دقیق متغییرهای سنتز و همچنین استفاده از عوامل پایدار کننده میتواند کیفیت محصول نهایی را بالا ببرد.
۵- منابـــع
[1]. Cushing, B.L., Kolesnichenko V.L., O'Connor, C.J., “Recent Advances in the Liquid-Phase Syntheses of Inorganic Nanoparticles”, Chemical Reviews, Vol. 104, pp. 3893-3946 (2004).
[2]. Skoog D.A., West D.M., Holler F.J., Crouch S.R., “Fundamentals of Analytical Chemistry”, 8th Edition, USA, Thomson Learning, (2004).
[3]. عبدالرضا سیمچی، آشنایی با نانوذرات (خواص، روشهای تولید و کاربرد)، چاپ اول، تهران، موسسه انتشارات علمی دانشگاه صنعتی شریف (1387).
[4]. مسعود صلواتی نیاسری، زینب فرشته، نانوشیمی، روشهای ساخت، بررسی خواص و کاربردها، چاپ اول، تهران،انتشارات سخنوران (1390).
۶- پاورقی
[1] Decantation
[2] Nucleation
[3] Growth
[4] Heterogeneous Nucleation
[5] Supersaturation
[6] Relative Supersaturation
[7] Dislocation Defect
[8] Polyhedral
[9] Ostwald Ripening
[10] Digestion
[11] Precipitate Solubility
[12] Complexing Agents
[13] Stabilizers
[14] Capping Agents
[15] Primary Layer
[16] Counter Ion Layer
[17] Hydrothermal
[18] Solvothermal